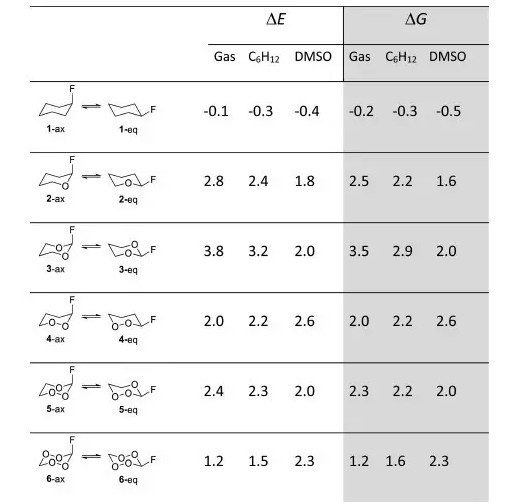
α-效应是从几十年前就出现在教科书中的术语,最初指的是一个动力学效应,即亲核试剂中心原子的α位若存在一个有孤电子的杂原子,其亲核性将显著上升(相比于根据pKa的预期值)。当亲核试剂结构类似时,可以将其与卤代烃反应速率对数值对pKa作图,此时往往得到近似的直线关系,从而可通过pKa读出预测的反应速率。如果对含氧负离子做出这一直线,便会发现过氧根离子对应的点远远高于该直线,其对应的反应速率与根据pKa的预期值相比有约1000倍的增强。类似的现象同样可以在次氯酸根、肼、羟胺等亲核试剂中发现。 对这一现象的经典解释是亲核中心原子邻近孤电子的存在将产生n(alpha)-n(center)的轨道混合,从而提高亲核试剂的HOMO能量。这一解释看似合理,但其忽略了很多潜在的复杂性。邻近杂原子的影响除了增加一个轨道混合之外,其电负性将导致HOMO能量未必有如此大的升高;此外,根据Bent规则,电负性取代基X引入到中心原子A后将导致A上孤电子s成分增加(这可以理解为A希望将更多p成分用于与电负性较大的原子X成键,以增强A-X键的离子成分从而提高键能),同样导致HOMO能量的降低。在之前的研究中,当杂原子A上进一步连接一个杂原子X后,其作为给体的强度是否真的提高了,仍然是一个未能解决的问题。7月12日发表在JACS上的文献 (Stereoelectronic Interactions as a Probe for the Existence of the Intramolecular α‑Effect)探讨了这一问题。 本文作者将异头效应作为衡量α-效应的尺度,系统地对α-效应涉及的立体电子问题进行了研究。 首先作者用NBO方法计算了肼和过氧化氢中杂原子的杂化情况,发现确实如同Bent规律所料,增加氧原子后O-R(R=H,OH)中N采取的杂化形式从sp3.24增加到了sp6.66,同时对应着孤电子s成分的增加和能量的降低。 α-F取代的氧杂环己烷存在异头效应,n(O)-σ*(C-F)的轨道混合导致直立式构象比根据A值预期的更加稳定。这一效应直接与O原子的给体强度相关。在MP2/6-311+G**水平下作者计算了气相和不同溶剂下一系列氧杂环己烷的构象分布(图1)。令人惊讶的是,对(应当存在α-效应的)氧杂环己烷4,气相和非极性溶剂中异头效应并没有变强。另一个有趣的现象是,虽然高极性溶剂削弱了普通的氧杂环己烷的异头效应,但对1,2-二氧杂的体系,DMSO中异头效应反而增加了,这说明两个体系中两种构象的偶极情况有所不同。这可以用O-O键的弱极性解释,这导致对应体系中两个构象的偶极矩相仿,从而消除了普通体系中平伏式不利的偶极作用。
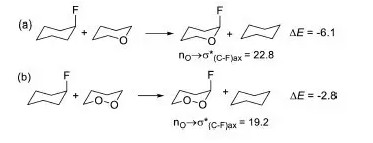
作者又用NBO分析了氧杂环己烷中的轨道相互作用。发现对于1,2-二氧杂的体系,n-σ*的作用与单氧杂的体系,反而变弱了(图2)。为了进一步确认这一结果,作者又设计了等键反应,发现确实1,2-二氧杂的体系的稳定化能小了3.3 kcal/mol, 与NBO对应的3.6 kcal/mol一致(图3)。作者认为轨道作用能的减小与s成分的变化有关。

作者同样研究了含N体系,结论与上述相同,即α-杂原子的存在降低了杂原子的给体强度。 为了研究是否一个更强的受体会导致α-效应的重新出现,因此将C-F键拉长到2 A, 模拟正离子特性。发现同样α-杂原子取代基只是让对应的体系变得不稳定了。类似的趋势出现在自由基中心,烷氧基与过氧基相比,对自由基的稳定化能更高。 根据这项研究,α-效应恐怕并非如之前广泛接受的解释那般是由前线轨道的混合导致的。相反的,一个电负性杂原子的存在只是降低了孤电子的活性。因此对应的动力学效应可能要归功于亲核试剂本身的去稳定化。